2020-07-22 来源:研发客
2020年7月22日,聚焦于基因治疗和细胞药物研发的上海邦耀生物科技有限公司(简称“邦耀生物”)宣布,邦耀生物与中南大学湘雅医院合作开展的“经γ珠蛋白重激活的自体造血干细胞移植治疗重型β地中海贫血安全性及有效性的临床研究”的临床试验取得初步成效,这是亚洲首次通过基因编辑技术治疗地中海贫血(简称“地贫”),也是全世界首次通过CRISPR基因编辑技术治疗β0/β0型重度地贫的成功案例。
邦耀生物治疗策略
该临床研究从患者体内分离出造血干细胞(HSC),通过CRISPR/Cas9基因编辑技术,在HSC中特定基因位点进行基因编辑,再将经基因编辑的HSC进行自体移植,使得患者自身血红蛋白水平达到正常范围,彻底摆脱输血依赖。
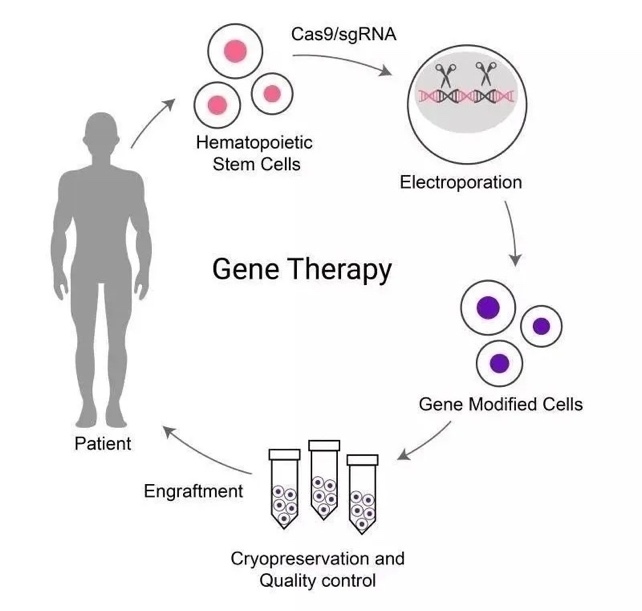
基于基因编辑技术治疗地贫的策略 来源|邦耀生物官网
两例接受治疗的患者分别为7岁和8岁的男性儿童,均为输血依赖型的重型β地贫患者(分别为β0/β0和β0/β+型),治疗前的输血频率约为15~20天两个单位的红细胞。接受治疗前患者进行了HSC的动员和单采,并由邦耀生物进行HSC的分离及基因编辑,然后回输到患者体内。经基因编辑的HSC移植治疗后,两名患者均成功达到造血干细胞植入以及造血重建。

地贫患者治愈出院
移植后,两名患者体内胎儿血红蛋白(HbF)在移植后1个月开始出现显著上升,随访60天时HbF水平分别上升至76g/L和97g/L。随访75天的数据显示,两名患者的总血红蛋白分别达到了129g/L和115g/L,已摆脱输血依赖。目前,两名患者的治疗后随访仍在进行中。
β-地中海贫血治疗现状
地中海贫血是全球分布最广、累及人群最多的一种单基因遗传病。根据《中国地中海贫血防治蓝皮书(2015)》的数据,目前我国“地贫”基因携带者约3000万人,涉及1亿家庭人口,且中度至重症地贫患者约30万人且正以每年约10%的速度递增。
β地中海贫血患者由于HBB基因的片段缺失或者突变,体内无法编码β珠蛋白或者产生有缺陷的β珠蛋白,从而不能与α珠蛋白形成功能正常的四聚体(成人血红蛋白,HbA)以携带氧气,引起严重的贫血及相关合并症。
据统计,每年约有6万名婴儿出生时患有严重的输血依赖性β地中海贫血(TDT),全球有超过20万名患者。
目前,地贫的常规治疗是规律输血和充分除铁治疗。许多TDT患者由于潜在的疾病和铁超负荷而经历严重的并发症和器官损伤。另外,传统的终身输血排铁治疗一生约需花费480万元,是绝大多数家庭不可承受的沉重负担。
若无价格高昂的频繁输血与除铁治疗,重型患儿多数于5岁内死亡。目前除了异基因造血干细胞移植外没有其他治愈方法。
在人体胚胎期,血红蛋白主要由γ珠蛋白(HBG基因编码)与α珠蛋白形成四聚体(胎儿血红蛋白,HbF)。出生后HBG表达被沉默,而HBB基因开始表达生成β珠蛋白,由其替代γ珠蛋白与α珠蛋白形成四聚体,即成体血红蛋白HbA。
临床研究发现,部分HBB基因缺陷的人群中没有出现严重的β地中海贫血临床表型,暗示重新激活地中海贫血患者的胎儿期HBG表达并获得较高水平的HbF可使地贫患者症状缓解,甚至完全治愈。本临床研究通过CRISPR/Cas9基因编辑技术,在HSC中特定基因组位点进行基因编辑,激活患者自身的HBG表达,从而大幅提高红细胞内γ珠蛋白的含量,使得血红蛋白水平达到正常范围。
邦耀生物科学家吴宇轩博士表示:“基因编辑技术治疗地贫属于全球基因治疗领域的前沿技术,目前仅有美国CRISPR Therapeutics公司于2020年报道过成功的案例,两名β0/β+患者在接收治疗后分别摆脱输血依赖5和15个月。而邦耀生物此次治疗的患者中有一位为β珠蛋白基因完全缺失的β0/β0型地贫,相比美国的临床试验,此次治疗难度更大。攻克了β0/β0型地贫这一难关,也就意味着所有输血依赖型地贫将可以通过此治疗策略得到根治。”
2020年1月13日,蓝鸟生物旗下的β-地贫基因疗法Zynteglo在德国上市。Zynteglo是一款新型基因疗法,该疗法先从患者体内分离出造血干细胞,利用病毒载体将经过修饰、能行使正常功能的β球蛋白基因插入患者自身的造血干细胞,然后将其回输回患者体内。
该疗法并没有引入基因编辑技术,而邦耀生物的β-地贫疗法通过将CRISPR/Cas9基因编辑技术引入治疗,激活患者自身的HBG表达,使得对于β-地贫的治疗更精准,发挥更大的疗效。并且,Zynteglo定价高达157.5万欧元(约合1210万人民币),名副其实地成为了全球第二昂贵的药物。相比Zynteglo,邦耀生物采用的治疗方案,更为高效、便捷和安全,且成本极大降低,有望成为更惠及大众的疗法。
聚焦基因治疗领域,不断突破升级
以基因治疗与细胞治疗为代表的医药领域正面临着前所未有的机遇,是未来十年在医药领域的重大突破方向。邦耀生物始终致力开发基因治疗创新药物,自成立之初就确立了“立足中国,布局全球,造福全球”的国际化战略,以满足中国及全球快速增长的医疗市场,为那些急需革命性基因疗法的病人带来佳音。邦耀在产品线选择、技术平台等方面均具有差异化竞争优势,针对核心管线产品——基因治疗β地贫,邦耀生物克服行业壁垒,既全面掌握基因编辑技术,又深入理解造血干细胞编辑策略,进而不断优化工艺,使基因编辑造血干细胞在治疗过程中的关键问题迎刃而解。
在先前的研究中,邦耀生物科学家团队在基因编辑工具开发和基因治疗地中海贫血领域,已经持续取得一系列突破性进展:利用基因编辑技术重新开启胎儿期的γ珠蛋白的表达,代替有缺陷的β珠蛋白,很有可能成为治愈地贫患者的治疗方案之一。
2019年3月25日,邦耀生物科学家、华东师范大学吴宇轩博士曾在Nature Medicine 发文,发现利用基因编辑技术靶向编辑BCL11A红系增强子,会重新开启γ珠蛋白表达,代替有缺陷的β珠蛋白,有望达到根治此类疾病的目的。
2020年1月8日,邦耀生物科学家、华东师范大学刘明耀教授及李大力教授团队在Cell Research 发文,通过在造血干细胞中建立超高效的基因编辑技术体系,模拟在部分人群中天然存在的γ珠蛋白启动子突变,可以重新激活胎儿血红蛋白HbF。
2020年3月17日,邦耀生物科学家、华东师范大学吴宇轩博士取得又一突破,在Nature Medicine 发文证实通过新一代单碱基编辑技术有望彻底根治由β珠蛋白突变引发的系列遗传疾病,有可能彻底根治此类疾病。
2020年5月11日,邦耀生物科学家、华东师范大学刘明耀教授及李大力教授团队在Nature Cell Biology 发文,开发了一系列超高活性的新型胞嘧啶碱基编辑器(命名为:hyCBE),hyCBE拥有更高的编辑活性和更宽的编辑窗口,对于β血红蛋白病的治疗具有更大的优势。
2020年6月1日,邦耀生物科学家、华东师范大学刘明耀教授及李大力教授团队在Nature Biotechnology 发文,该研究开发出了一种新型双功能碱基编辑器(命名为:A&C-BEmax),打破了现有碱基编辑器限制,开发源头创新的新型双功能碱基编辑器,为基础研究和遗传性疾病如β-地中海贫血的治疗提供了新的平台。
目前,邦耀生物与华东师范大学密切合作,已搭建了创新、高效的基因编辑平台,正着力围绕这几项自主技术开展临床转化。
文章转载自 研发客,原文链接:http://www.pharmadj.com/cms/detail.htm?item.id=3e73c02bcb5011ea8efdfa163e227c38