2020-05-27
前言:单碱基基因编辑技术,自2016年4月被报道以来,因其不引入DNA双链断裂,且编辑更加高效、安全而备受关注,近几年来逐渐成为地中海贫血、血友病等遗传疾病基因治疗的热门工具之一。然而,现有的碱基编辑器只能催化单一类型碱基C或A,这在较长时间和很大范围内限制了其广泛应用。因此,开发一种简单且高效的碱基编辑器实现两种不同类型碱基转换,即同时实现C>T和A>G,一直是碱基编辑器优化探索的重点和难点。
2020年6月1日,上海邦耀生物科技有限公司(下称邦耀生物)与华东师范大学刘明耀教授及李大力教授团队合作,在国际著名学术期刊Nature Biotechnology杂志发表了题为“Dual base editor catalyzes both cytosine and adenine base conversions in human cells”的研究论文。这也是邦耀生物在2020年,继发表在Nature Medicine、Nature Cell Biology、Cell Research等期刊的基因治疗成果后,在单碱基编辑工具开发领域的又一重大突破,为基础研究和遗传性疾病如β-地中海贫血的治疗提供了新的发展方向和工具。华东师范大学张晓辉,朱碧云和陈亮为本文共同第一作者,华东师大生命科学学院李大力教授为通讯作者。

该研究将胞嘧啶脱氨酶hAID-腺嘌呤脱氨酶-Cas9n(SpCas9 D10A突变体)融合在一起,开发出了一种新型双功能碱基编辑器-命名为:A&C-BEmax,它不仅可以实现单独的C>T或A>G,还可以在同一等位基因上同时实现C>T和A>G的高效转换。与已报道单碱基编辑器(ABE或CBE)相比,A&C-BEmax可使C>T的编辑窗口被拓宽,效率得以提升;A>G的窗口保持不变,效率略微下降;RNA脱靶水平大大降低。
独辟蹊径,同时实现两种碱基高效转换
由于CBE和ABE只能催化单一碱基的转换,研究团队猜测如果重新组合胞嘧啶和腺嘌呤工具,是否能实现两种碱基简单而高效的转换呢?因此,通过将胞嘧啶脱氨酶hAID和腺嘌呤脱氨酶在Cas9n两端进行位置的不同组合融合成了五种构建体,通过哺乳动物细胞测试,发现将胞嘧啶脱氨酶融合到ABE7.10的N端展现出A/C同时转换的特性,但此时效率偏低。
不断优化方案,实现更高编辑效率
为了克服效率偏低的难题,研究团队不断尝试和调整技术方案,最终发现通过优化ABE7.10-N-AID中的Cas9n密码子,融合双分型核定位信号(bpNLS),优化linker序列和融合两个拷贝的尿嘧啶DNA糖基化酶抑制剂(UGI),获得了一种高效的A/C同时转换的编辑器,将其命名为:A&C-BEmax(图1)。
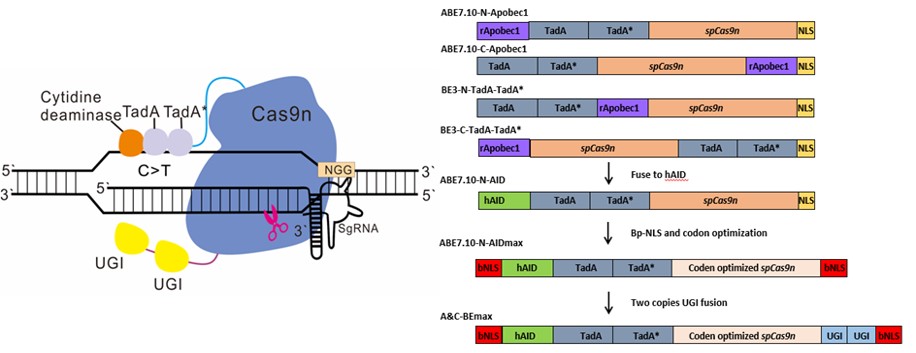
图1:A&C-BEmax模式图及不同构建体
A&C-BEmax:一种非常特异的双功能碱基编辑器
与原始构建体相比,A&C-BEmax的碱基转化效率,产物纯度和A/C同时转换活性显著提高,C>T的编辑窗口大幅增加,且更安全,RNA脱靶率更低。为了更加广泛的评价A&C-BEmax的性能,科研人员在HEK293T细胞中测试了28个内源性靶点(其中4个靶点仅包含Cs或As),同时与ABEmax和AID-BE4max进行对比。
测试显示,在同一靶点,A&C-BEmax的C>T编辑窗口从C3-C10位扩展到了C2-C17位,在C7-C17位的编辑活性相对于AID-BE4max提高了1.9-14倍(图2),而A>G的编辑效率与ABEmax相似或略有降低,但比ABEmax在RNA上的脱靶率更低,同一等位基因的A和C同时突变效率最高达到30%。同时,数据表明,与CBE和ABE相比,A&C-BEmax编辑效率、产物纯度、碱基突变的饱和度及突变类型和A/C同时转换活性显著提高,几乎不产生DNA脱靶以及RNA水平的脱靶也大大降低。由此可见,A&C-BEmax是一种具有高特异性且安全的双功能碱基编辑器。
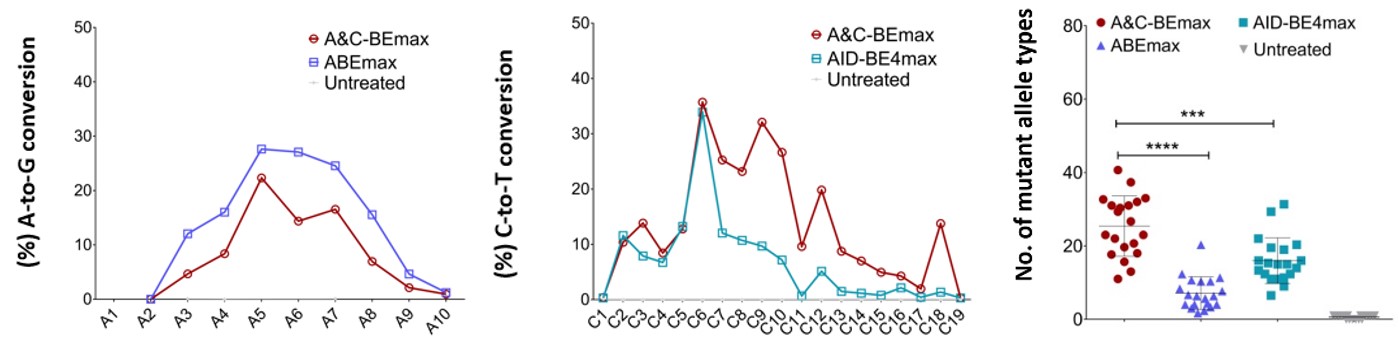
图2:A&C-BEmax的工作特性
新型编辑器在地贫治疗,表现巨大潜力
为了进一步验证A&C-BEmax在基因治疗中的应用,将A&C-BEmax递送到类红细胞前体细胞中(HUDEP-2),结果表明,A&C-BEmax能有效地联合破坏BCL11A转录抑制因子结合位点(-114C>T或-115C>T),并同时创建转录激活因子GATA1的结合位点(-113A>G),这是现有ABE或CBE都无法做到的,与周围单独产生C的编辑细胞相比,A/C同时突变后分化的HUDEP-2细胞具有更高的HBG表达水平(图3)。该工作展示了A&C-BEmax新型碱基编辑系统对于在高效治疗β-血红蛋白病的巨大潜力,为彻底治愈重症β地贫提供了新的方法。
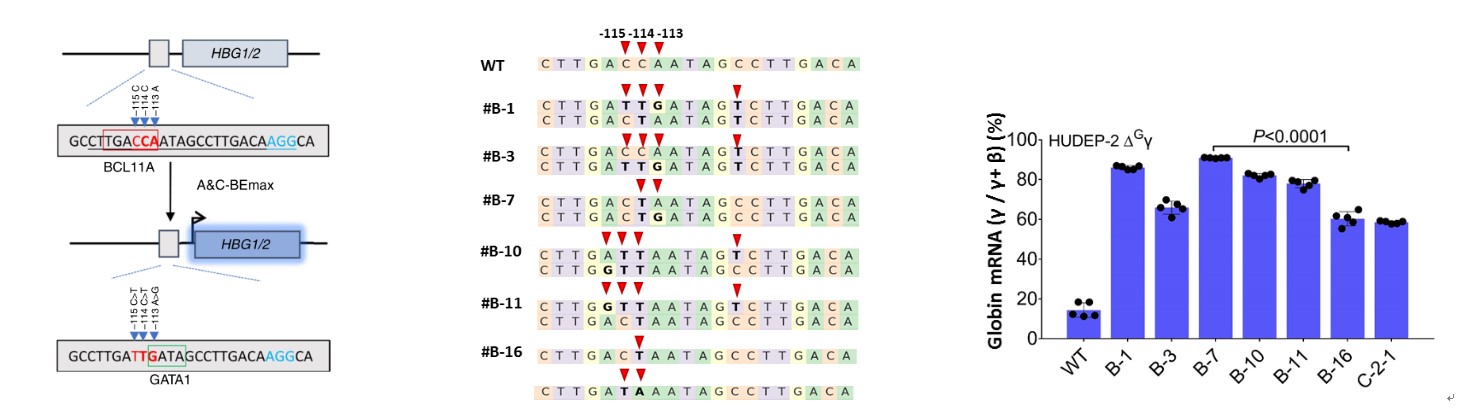
图3:A&C-BEmax在HUDEP-2细胞中高效激活HBG表达
最后,研究团队通过计算机在Clin Var和dbSNP(SNPs)临床数据库中分析了所有A&C-BEmax可靶通过联合C>T和A>G靶向纠正203个临床报道的致病突变;进一步拓展PAM为NG时,靶向范围增加了2.8倍(〜573)。这表明A&C-BEmax在联合C>T和A>G纠正引起人类致病突变方面拥有巨大的临床应用潜力。
邦耀生物深耕基因治疗领域,突破不断
邦耀生物自成立以来,一直聚焦于基因编辑和基因治疗领域,自主研发并搭建起基因治疗技术转化平台,并且在基因编辑和基因治疗领域已经递交30余项全球及中国专利申请。回首邦耀生物的开拓之路,是一段不断突破与创新的过程,特别是去年以来,邦耀科学家团队在基因编辑工具开发和基因治疗地中海贫血领域,已经持续取得很多突破性进展:
2019年3月,邦耀生物科学家吴宇轩博士,在Nature Medicine发文,发现利用基因编辑技术靶向编辑BCL11A红系增强子,会重新开启γ珠蛋白表达,代替有缺陷的β珠蛋白,有望达到根治此类疾病的目的;
2020年1月,刘明耀教授和李大力教授团队,率先证明单碱基编辑器编辑技术靶向HBG启动子激活胎儿期血红蛋白的表达,对于治疗β地中海贫血的可行性与有效性,相关研究发表在国际著名学术期刊Cell Research;
2020年3月,邦耀生物科学家吴宇轩博士,在国际著名学术期刊Nature Medicine发文,证明单碱基编辑技术可以靶向BCL11A的红系增强子原件激活胎儿期血红蛋白,或者编辑β血红蛋白基因的特定突变,有望通过编辑自体造血干细胞治疗包括β地贫在内的β血红蛋白病;
2020年5月,最新发表在Nature Cell Biology的文章又报道了李大力教授团队最新自主研发的hyCBEs系列工具拥有更高的编辑活性和更宽的编辑窗口,对于β血红蛋白病的治疗具有更大的优势;
本次突破研究,更是打破现有碱基编辑器限制,开发源头创新的新型双功能碱基编辑器,打造国内自主知识产权的基因编辑工具的重大研究成果,为基础研究和遗传性疾病如β地中海贫血的治疗提供了新的平台。
邦耀生物联合创始人、总裁席在喜先生透露:邦耀生物已搭建了创新、高效的基因编辑平台,邦耀在2020年以来在单碱基编辑器及其在基因治疗遗传疾病中的一系列突破性进展,将会为基因治疗再添利器,邦耀生物正着力围绕这几项自主知识产权技术开展临床转化。自成立以来,邦耀生物一直聚焦于基因药物和细胞药物的开发,目前已与国内多家医疗单位合作,在遗传疾病及恶性肿瘤的研究中取得了阶段性突破。我们期待未来为更多癌症和遗传疾病患者带来福音。
附原文链接:Zhang, X., Zhu, B., Chen, L. et al. Dual base editor catalyzes both cytosine and adenine base conversions in human cells. Nat Biotechnol (2020).
https://doi.org/10.1038/s41587-020-0527-y