2018-08-09
前言
2018年8月8日,国际著名学术期刊Science Advances在线发表了邦耀科学家杜冰教授在天然免疫方向的题为“Kisspeptin/GPR54 signaling restricts antiviral innate immune response through regulating Calcineurin phosphatase activity”的研究成果[1]。华东师范大学生命科学学院杜冰教授和钱旻教授是该论文的共同通讯作者,博士生黄洪军、硕士生熊青青以及王宁为论文共同第一作者。

研究背景
“神经-内分泌-免疫网络”学说
神经、内分泌以及免疫系统是人体内最重要的三大系统,长期以来,三大系统被认为各司其职,自主行使功能。1977年Basedousky提出了著名的“神经-内分泌-免疫网络”学说,证明原认为彼此独立的神经、内分泌、免疫三个系统各司其职,又互相调节,构成一个机体整合和调控“网络”。现在,越来越多的资料逐渐表明,神经-内分泌-免疫系统之间存在双向性信息传递和相互作用,三者的相互作用对机体稳态和健康的维持起着关键性作用。同时,神经、内分泌以及免疫系统之间的相互作用也形成了人体内最复杂的调控网络,而这些调控作用的分子机制已成为生命科学研究中的热点和难点。
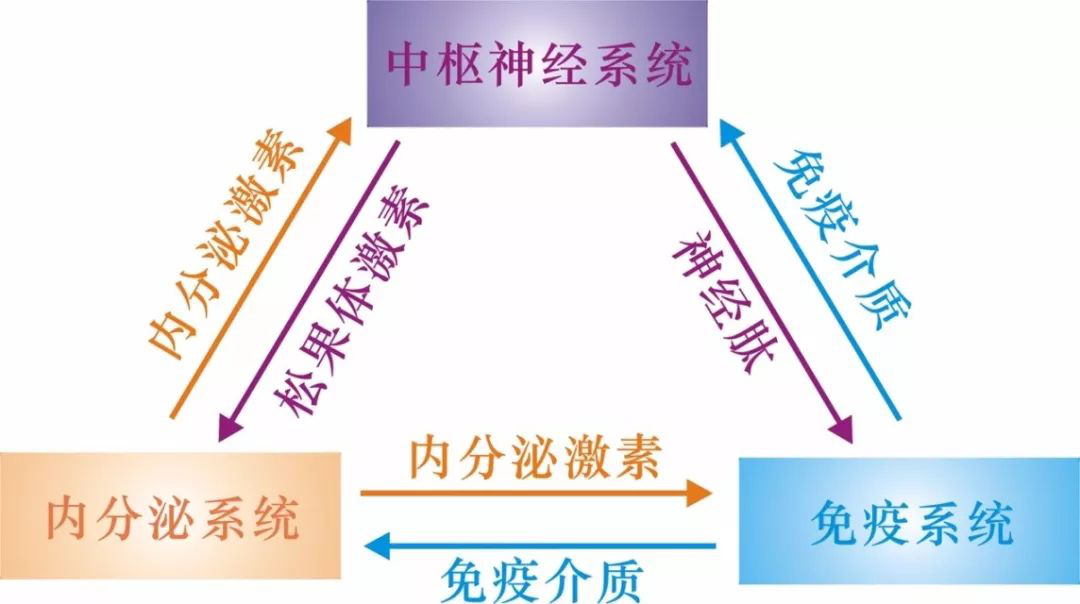
图:神经-内分泌-免疫系统之间的双向性信息传递作用
天然免疫作为机体抵御病毒感染的第一道防线,其通过模式识别受体识别病毒的核酸组分来引发下游抗病毒因子I型干扰素的产生,I型干扰素以自分泌或旁分泌的形式作用于细胞膜表面的I型干扰素受体进而诱导数百个干扰素诱导基因的表达,这些干扰素诱导基因可以在病毒感染的不同阶段、以不同的方式干扰病毒的复制,因此I型干扰素在抗病毒天然免疫中发挥着关键作用。近些年,基于模式识别受体对病毒核酸组分的识别以及其激活的干扰素信号通路的调控逐渐成为抗病毒天然免疫研究的核心与前沿。
G蛋白偶联受体(GPCR)作为人体内最大的受体家族具有十分重要的生理和病理功能,临床使用的药物有近40%直接或间接靶向GPCR,是目前最重要的药物治疗靶标。华东师范大学生命科学院长、邦耀首席科学家刘明耀教授团队多年来一直致力于GPCR的功能及分子机制研究,相关研究成果先后发表在Science、Nature、Nature Medicine、Nature Biotechnology等国际顶级期刊。
近年来,团队成员杜冰教授和钱旻教授聚焦于GPCR对于肿瘤及免疫微环境的调控功能和机制研究,尤其是对于富亮氨酸受体家族(LGR)、嘌呤受体家族等GPCR亚家族开展了一系列深入研究,相关研究成果发表在Science Advances、Cancer Research、Journal of Immunology、Cellular& Molecular Immunology、Journal of BiologicalChemistry等国际知名期刊,为深入理解体内复杂的免疫微环境调控机制奠定了坚实的理论基础。
作为国际上最早一批开展GPR54(Kiss-1R)及其配体Kisspeptin功能研究的团队,刘明耀教授早在2011年就报道了GPR54及其配体在乳腺癌以及肺癌中的重要作用,提示GPR54有望作为肿瘤治疗的新靶点[2-3]。本论文基于我们在GPR54功能及分子机制研究上的丰富经验和技术平台,从巨噬细胞介导的抗病毒免疫角度对GPR54及其配体的免疫调控功能进行了深入研究,进一步扩展了对神经内分泌系统调控免疫功能的认识。鉴于固有免疫系统在肿瘤免疫微环境中的重要作用以及GPR54对于肿瘤发生、发展的调控功能,我们的研究也为靶向GPR54的肿瘤免疫治疗提供了新的思路。
研究结果
该论文研究发现,当给予小鼠病毒的感染时,小鼠下丘脑和垂体中神经肽激素Kisspeptin的表达会显著提高,这些神经肽激素再通过血液循环系统以旁分泌的形式作用于免疫细胞表面表达的GPR54受体,进而通过抑制抗病毒因子I型干扰素的产生,降低机体的抗病毒免疫功能。
为了进一步明确上述结果的分子机制,接着作者利用GPR54基因缺失的小鼠进行验证,发现这些小鼠对于病毒感染的耐受能力会显著提高,病毒诱导的死亡率也明显降低。这些数据提示神经肽激素Kisspeptin极有可能被病毒所劫持,参与了病毒在机体内的免疫逃逸。
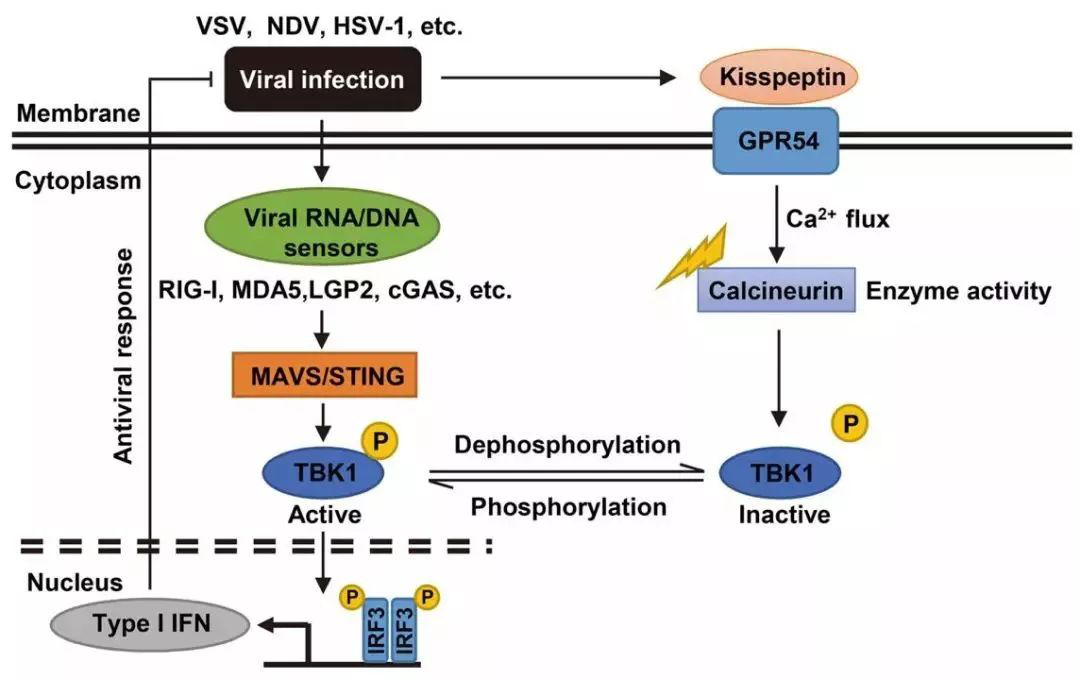
图:固有免疫系统在识别病毒后会大量释放I型干扰素以提高机体的抗病毒免疫功能。然而病毒的入侵同时也会诱导体内Kisspeptin的表达,通过与GPR54的结合激活Calcineurin的活性,使TBK1发生去磷酸化,进而降低I型干扰素的释放,为病毒的进一步入侵提供便利。
更加值得关注的是GPR54的缺失不仅能够抑制VSV、NDV以及HSV等病毒的复制,还能够显著降低病毒诱导的急性肺部炎症。因此,研发GPR54特异性的阻断剂不仅可以抑制病毒在体内的复制,还能够有效缓解由病毒感染所引起的急性炎症反应,具有非常重要的药物开发前景。
结论
本文的研究不仅感染性疾病的治疗提供新的思路,同时也从抗病毒天然免疫的角度阐明了一条神经内分泌系统调控固有免疫系统的新途径,从一定程度上揭示了神经、内分泌、免疫调控网络相互作用的生物学规律。
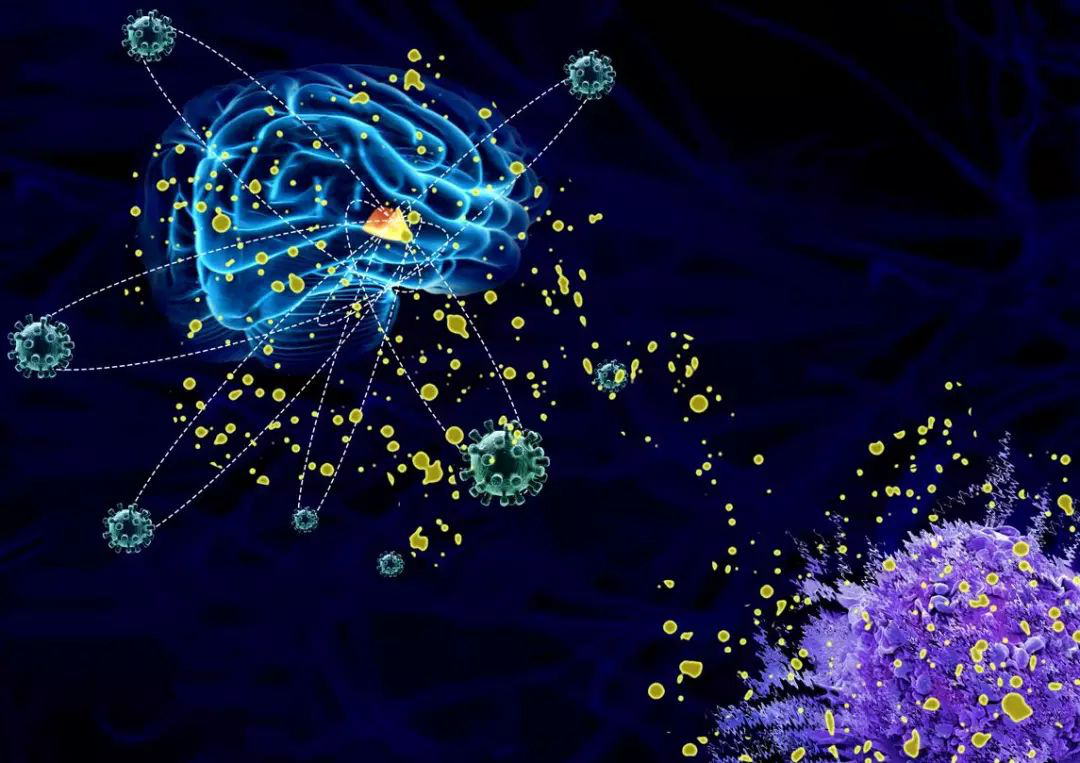
图:病毒挟持神经内分泌系统释放Kisspeptin,通过激活免疫细胞表面的GPR54受体抑制抗病毒免疫应答
成果转化
综上所述,该项工作不仅为深入理解神经、内分泌以及免疫系统之间的复杂调控网络提供了线索,同时也为将Kisspeptin/GPR54发展成为病毒性疾病治疗的重要靶点提供了理论依据,具有很大的临床转化潜力。目前该团队成员正积极响应国家关于加快科技成果转化,推动生物医药创新发展的号召,积极开展靶向GPCR的药物临床转化研究。
邦耀生物有幸和华师大的科学家们一起参与肿瘤免疫疗法的研发,充分利用GPCR作为药物治疗靶标的天然优势,与国内多家顶级医疗单位携手,以临床转化为导向,将GPCR介导的免疫调控与免疫检查点阻断以及CART细胞治疗紧密结合,着力解决实体瘤免疫抑制环境对肿瘤免疫治疗技术的阻碍,为新型肿瘤免疫治疗靶标的发现和应用研究提供了新的思路。
参考文献
[1] Huang H, et al. Kisspeptin/GPR54 signaling restricts antiviral innate immune response through regulating Calcineurin phosphatase activity,Science Advances, 2018.
[2] Cho S, Li D, Tan K, et al. KiSS1 and its G-protein-coupled receptor GPR54 in cancer development and metastasis[J].Cancer and Metastasis Reviews, 2012: 585-591.
[3] Cho S, Wang Y, Rodriguez M, et al.Haploin sufficiency in the Prometastasis Kiss1 Receptor Gpr54 Delays Breast Tumor Initiation, Progression, and Lung Metastasis[J]. Cancer Research, 2011,71(20): 6535-6546.