2019-08-09
随着科学研究的深入,我们对样品指标的分析要求也越来越高,希望能够在有限的样品中获取尽可能多的数据。多色流式就是一项为此量身定做的实用技术。但如何保证数据质量,在很大程度上取决于优化的配色方案设计。
经常会有初入流式分析的同学来问到,师兄,这个荧光强不强?这个通道能测出来不?是不是抗体不好使?为啥这个补偿怎么也调不干净?为啥(明明)感觉(应该)阳性群不明显(很明显)等等问题。其实导致这些问题的原因有很多,可能来源于抗体、荧光素的选择,样本处理,上机操作,及后续的分析过程中。本期,让我们结合流式分析仪的基本原理,来看看多色流式中荧光配色的方案及其原理。
01、首先了解:流式分析的基本步骤
一次完整的流式分析,通常可以概括为四步走,【样本制备】→【染色标记】→【上机操作】→【后续分析】。但是在成功地完成一次流式分析之前,我们还需要做大量的准备工作,我们可以将之分为【实验设计】、【预实验】。
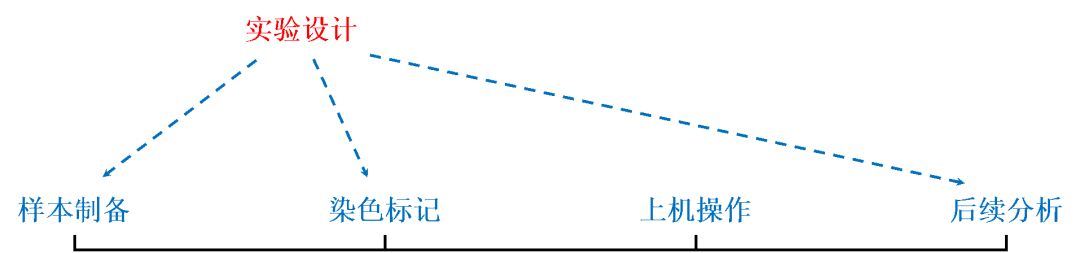
行兵布阵讲究的是谋定而后动,同样地,做流式分析时实验设计也相当重要。在这个环节,我们需要对消化方案、抗体标记策略、荧光配色方案等等做初步规划,并在预实验中逐步完善,最终在正式实验中获得预期的数据结果。
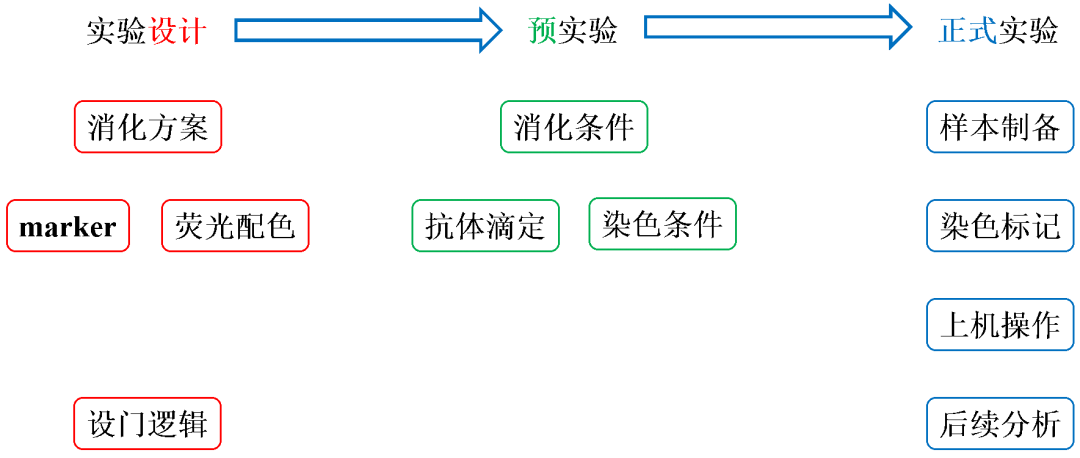
本期,我们主要关注实验设计中的荧光配色。但在正式讨论荧光配色前,我们先来聊一聊流式分析仪的基本原理,相信这会对我们后续更好地运用荧光配色有所帮助。
02、流式分析仪的基本原理
流式分析仪的识别过程可以简单分为【光信号】→【电信号】→【数字信号】→【输出】。具体过程如下:
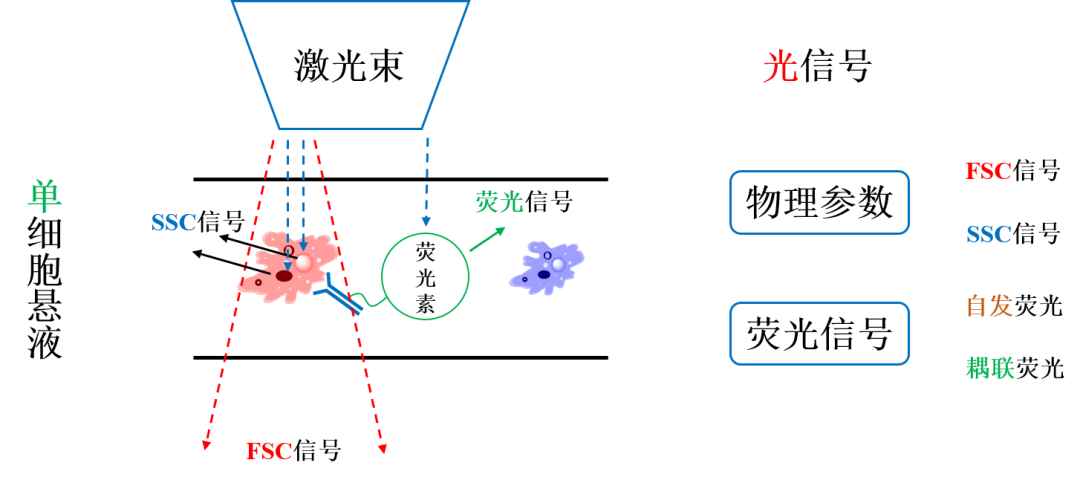
流式细胞术原理图
1. 光信号的接收识别
分析仪中的光路系统通过激光束照射流动通过的单细胞悬液,产生不同的光信号,其中包括无需激发的物理参数信号(FSC、SSC)和需要一定能量的激光束激发的荧光信号。没有照射到细胞的激光束,向前直射形成前向散射光信号(FSC),因此在一定范围内,FSC与细胞的大小正相关;接触细胞的激光束,产生不同的折射光信号,包括侧向散射光信号(SSC)、荧光信号。细胞内的复杂程度越高,折射的SSC信号就越强,因此在一定范围内,SSC与细胞内的复杂程度成正比。同时,由于SSC信号一般较弱,荧光信号通常能够从折射光信号中分离出来,再经过不同的滤光片分离,从而被特定的接收器(通道)接收。
2. 光信号的转换输出
接下来,光电二极管(用于FSC)、光电倍增管(用于SSC、荧光信号)会将【光信号】转换成【电信号】,并最终转换成【数字信号】在图形界面【输出】,到此我们就能够直观地看到我们所需要的流式图了。
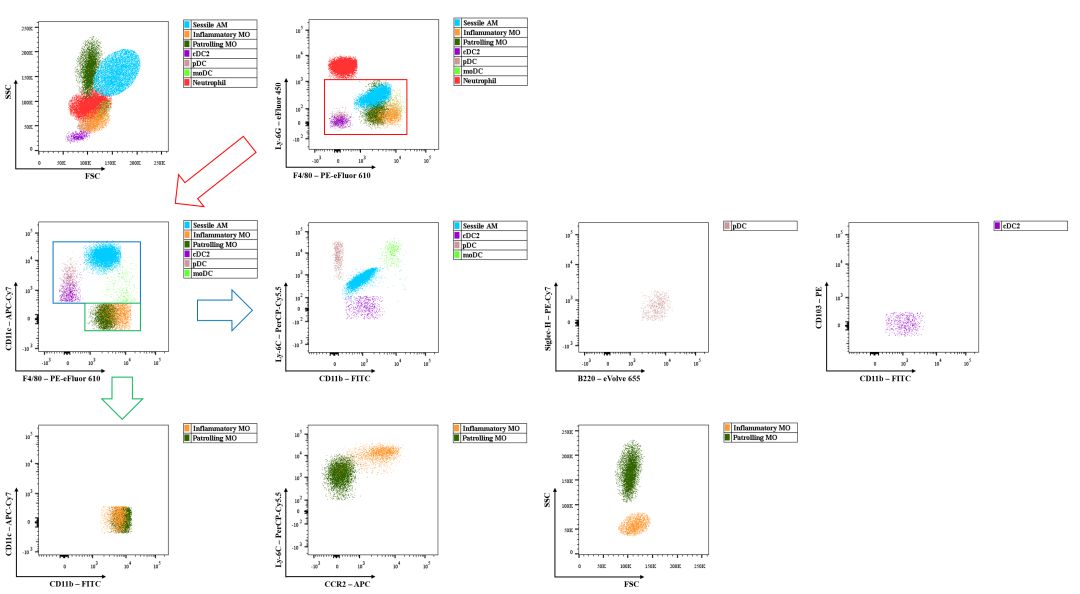
多色流式分析示例图(小鼠肺实质细胞群中MO/MΦ/DC相关亚群的参考圈门策略)
因此,如何让流式分析仪获取足够强度并且准确的光信号,是获得优质流式数据的关键。在这里,有两个关键指标:准确性、强度,将成为我们设计荧光配色方案的衡量标准。
03、荧光配色方案之准确性指标
准确性:即如何让荧光信号和谐共处、各自安好地被识别。一般在阅读了大量文献的基础上(新手上路的默认必须操作,老司机也请注意行车规范),我们会确定在单一样品中需要标记的不同marker。主要分为以下几个步骤:
1. 找到在流式分析仪上可识别的荧光素
通常我们会用不同荧光素标记的抗体来结合marker,因此可用的荧光素有数量、种类上的限制。
1) 数量:受到分析仪接收器(通道)的限制,以BD LSRFortessa(以下简称Fortessa)为例,选配为5激光18通道,因此单管样品染色的荧光素【数量】上限为18。
2) 种类:受到激光管波长、滤光片2个因素的限制。以BD FACSCalibur(以下简称Calibur)为例,选配为2激光(488nm、635nm)4通道。受到激光管波长的限制,以355nm、405nm激发的荧光素(BUV375、BV421等)并不能在Calibur上应用;受到滤光片的限制, PerCP与PE-Cy7在Calibur上均为488nm激发,均被FL3(670LP)识别接收,不能同时适用。但在Fortessa上能够二者能分别被488nm、561nm激发,分别被FL2(710/50nm)、FL7(780/60nm)识别接收,能够同时适用。
2. 在可用的荧光素中,找出能够和谐共处、各自安好的组合。
流式分析仪识别的荧光信号,一部分来源于激光激发细胞本身蛋白产生的荧光信号,我们称之为“自发荧光”,另一部分来源于结合到细胞上的抗体耦联的荧光素被激光激发后产生的信号。
在选用荧光素的时候,首先要尽量避开自发荧光的发射光谱范围,避免自发荧光对目标荧光信号的干扰。其次,我们要尽可能地基于“荧光素强度”、“相互干扰程度”两方面和谐共处的原则来选用荧光素。
举例:以5色标记,Fortessa为例
组合1:PE、PE-eFluor610、PE-Cy5、PE-Cy5.5、PE-Cy7
组合2:BV421、FITC、PE、PE-Cy7、APC
一般我们可能习惯于根据“荧光素强度”从高到低开始翻牌,但是对于多色流式而言,荧光素之间发射光谱的“相互干扰程度”非常关键,轻视它的后果就是会在补偿调节的时候让你调到怀疑人生。
组合1是一个极端配色方案(相信一般人不会想去挑战这个补偿调节),这是一组PE和PE耦联荧光素的组合,在Fortessa上这个组合均由561nm激发,被范围接近的滤光片分离,并被接收识别。虽然各自的“荧光素强度”足够,但是由于在561nm 的激发下,它们的发生光谱有明显的交叉重叠区域(如图所示),即它们之间的“相互干扰程度”很高,这会让补偿调节变得相当困难,进而导致信号失真的可能性增大。这个时候,我们会选择在可接受的范围内牺牲“荧光素强度”。例如选用荧光强度不那么强的FITC、APC-Cy7等来避开难以调节的补偿参数,组合2就在一定程度上,兼顾了“荧光素强度”和“相互干扰程度”。
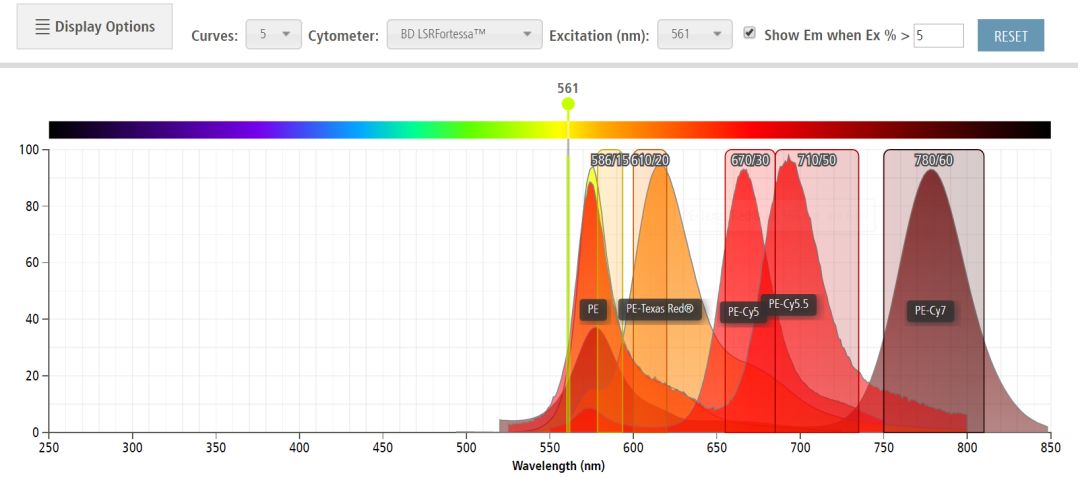
在561nm激发下,组合1的发射光谱分析
www.bdbiosciences.com/en-us/applications/research-applications/multicolor-flow-cytometry/product-selection-tools/spectrum-viewer
04、荧光配色方案之强度指标
强度:即在满足准确性的荧光素组合内,通过荧光素的分配,让我们所有希望了解的marker,都能刷出存在感。在这里给大家2个经验之谈,大神勿喷。
1. 高低搭配,出图不累。
我们可以将光信号强度理解为【marker丰度×荧光素强度】,因此对于低丰度的marker,我们要拉一把,配一个高强度的荧光素。例如,目标细胞群体为小鼠来源的pDC(浆样DC),部分marker为Siglec-HloF4/80mid,配色为PE(强)、APC-Cy7(弱),考虑的配色方案为,Siglec-H-PE、F4/80-APC-Cy7。此外,对于低丰度的marker,直接利用阳性群进行补偿调节可能会引起信号失真,因此可以考虑采用Compbead捕获抗体或者采用高丰度marker搭配耦联同样荧光素的抗体进行近似调节。
2. 同一层面,补偿走开。
在多色流式分析的过程中,我们通常会设置多个逻辑层和门。在同一层次的逻辑设门中,可以考虑避开那些八字不合补偿难以调节的荧光配对。例如,层次1(F4/80、Ly-6G)→层次2(CD11b、CD11c),配色为eFluor 450、PE-eFluor 610、FITC、PE。个人考虑的配色方案中,PE与PE-eFluor 610不放在同一逻辑层,采用F4/80-PE-eFluor 610,Ly-6G-eFluor 450,CD11b-FITC,CD11c-PE。如果有童鞋感兴趣,可以尝试把PE、PE-eFluor 610凑对,就会发现存在对角线尖峰,若通过补偿调节将尖峰调没,可能会补偿过度,从而导致一些细胞亚群的信号失真,得不偿失。
05、总 结
荧光配色的目的,是为了让流式分析仪能够“准确”地识别足够“强度”的荧光信号。
▲ 从准确性出发,我们要根据硬件限制(激光管、通道数、滤光片)选出可用荧光素,在可用荧光素中,根据“荧光素强度”、“相互干扰程度”、“自发荧光”等选出较优的配色组合。
▲ 从强度出发,我们要让每一个目标marker都能获得足够被识别的荧光强度信号,因此要根据“高低搭配”、“逻辑设门”等来作出最终的荧光分配方案。