2022-09-17 来源:医麦客
2022年9月17日/医麦客新闻 eMedClub News/--今日,据国家药监局药品审查中心(CDE)官网显示,上海邦耀生物科技有限公司(以下简称“邦耀生物”)“靶向CD19非病毒PD1定点整合CAR-T细胞注射液”(管线代号:BRL-201)的临床申请获得受理(受理号:CXSL2200465)。
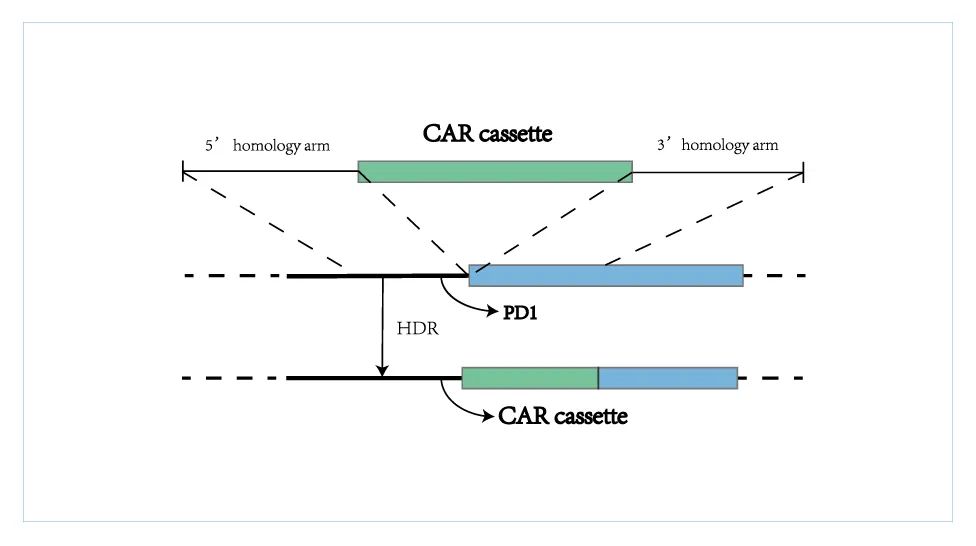
据官网介绍,BRL-201是邦耀生物利用其专有的非病毒定点整合CAR-T平台(Quikin CART®平台)开发的靶向CD19的CAR-T产品,适应症为复发/难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)。值得一提的是,这是世界首个靶向CD19非病毒PD1定点整合的CAR-T产品。
传统CAR-T产品的制备主要通过病毒载体,这导致了其具有潜在的致瘤风险,同时所制备的CAR-T细胞均一性较低,而制备时间长,生产成本高,亦是无法避开的挑战。
而Quikin CART®技术平台可以有效解决使用病毒载体带来的几大难题,展现出了巨大的优势。定点整合可以让每个CAR序列都精确地插入到基因组的特定位点,能避免随机插入导致的致瘤风险,最大程度保证了CAR-T产品的安全性和有效性。只需一步制备,即可同时实现CAR的持续性表达和T细胞内源基因的调控,大大缩短了整个CAR-T产品的制备时间,得以让更多患者受益。另外,使用非病毒生产工艺还可以极大减少因使用病毒载体带来的高昂成本。
该平台开发的PD1-CD19-CART产品,具有PD1基因敲除和CAR均一性稳定表达双重优势;此外,据邦耀生物官网介绍,该平台还可用于多个免疫检查点敲除增强型CAR-T细胞的制备,快速生产通用型CAR-T细胞并开发动态调控的安全型CAR-T产品等,为今后CAR-T细胞改造提供了强有力的技术支持。
此前,邦耀生物和浙江大学医学院附属第一医院合作的已开展的BRL-201治疗复发难治性非霍奇金淋巴瘤的研究者发起的临床试验(IIT)最新研究结果发表在了顶级期刊Nature上。本次IND申请或许正是基于这项最新的临床研究结果支持。

研究结果显示,8例患者接受治疗后,未观察到CAR-T相关的神经毒性和2级以上细胞因子风暴,证明了BRL-201具有出色的临床安全性。根据检测结果显示,CAR-T细胞回输后能在患者体内快速扩增并持续较长时间,接受治疗后87.5%的患者获得了完全缓解(CR)的效果,所有患者均对治疗响应,客观缓解率(ORR)为100%。
迄今,接受该CAR-T疗法的患者无癌生存期最长已超过2年,目前仍处于疾病完全缓解的状态。值得一提的是,无论是针对PD-L1高表达肿瘤患者的治疗,还是在CAR-T细胞回输剂量和阳性率较低的条件下,BRL-201均显示出了良好的疗效,证明了其具有强大的肿瘤杀伤能力。
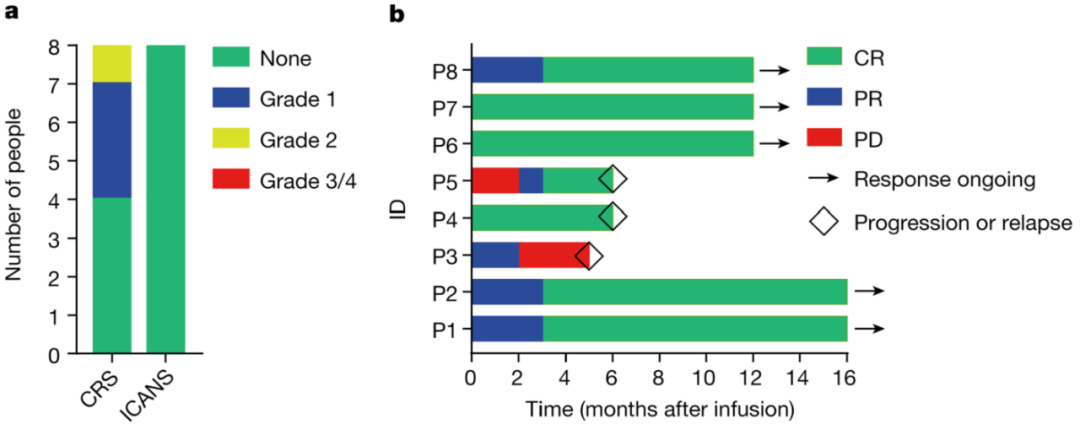
▲BRL-201在临床上体现了出色的安全性和有效性
转载自医麦客微信公众号,文章链接:https://mp.weixin.qq.com/s/LHoB1T2KW0XmW884NSHBnA