2018-07-10
前言
近几年来,免疫治疗迎来了空前盛世,不可否认的是,在已过去一半的2018年里,它依然是大家关注的焦点,层出不穷的报道相继而来,让更多的肿瘤患者看到了治愈的希望!然而,在风光无限好的背后,不少科学家也洞悉到:目前的大多数免疫疗法的临床响应率还停留在20%左右的低水平。究其根源,原来在于肿瘤建立的免疫抑制微环境。近日,来自华东师范大学、邦耀实验室的科学家团队发现:GPCR家族成员--Lgr4在肿瘤免疫调节中扮演着关键作用,以其作为治疗靶点将为肿瘤免疫治疗提供一个新的视角。
2018年7月2日,国际著名肿瘤学期刊Cancer Research 在线发表了题为“Inhibition of Rspo-Lgr4 facilitates checkpoint blockade therapy by switching macrophage polarization”的研究成果[1]。华东师范大学生命科学学院院长、邦耀生物首席科学家刘明耀教授及杜冰教授为该文共同通讯作者,华东师大博士后谭炳合为该文第一作者。

研究背景
GPCR(G protein-coupled receptors)为G蛋白偶联受体,它在人体内分布广泛,功能复杂,参与调控众多生理过程如心血管、神经、免疫、代谢和内分泌系统等。Lgr4是富含亮氨酸基序的GPCR家族成员,多年来被认为是通过结合R-spondin分泌蛋白,促进和放大经典的wnt/β-catenin 信号通路[2,3],广泛在个体和器官发育[4,5]乃至肿瘤细胞转移[6]方面发挥重要调控作用。然而关于Lgr4对于肿瘤免疫微环境的调控作用仍是个未解之谜。
刘明耀教授团队长期以来专注于GPCR信号转导研究与新药研发工作,先后发现了GPR54、GPR116以及LGR4等一系列GPCR家族重要成员在肿瘤发生、发展中的重要调控作用,尤其是对于Lgr4的研究在国际上取得了十分重要的影响。
如2016年发表在Nature medicine杂志上[7],首次揭示Lgr4作为RANKL蛋白的受体在哺乳动物的噬骨/成骨平衡过程中发挥关键作用,以此为基础开发了基于Lgr4受体封闭的骨质疏松治疗手段;而在2013年发表在JBC杂志上的研究发现Lgr4可以通过cAMP/PKA/CREB信号通路调控固有免疫系统中TLR2/4介导的模式识别功能[8]。
在2018年5月,最新发表在FASEB J.上的文章也表明,Lgr4在乳腺癌的发生发展、转移及干细胞分化上具有重要的调控作用[9]。而这些工作均提示我们Lgr4与肿瘤及免疫微环境之间重要联系。
虽然近年来肿瘤免疫疗法取得了突破性的进展,然而无论是对于免疫检查点阻断疗法还是CAR-T细胞疗法,实体瘤内部免疫抑制的肿瘤微环境Tumor immune microenvironment (TIME)始终是难以逾越的障碍。如肿瘤微环境中PD-L1等T细胞抑制信号的大量表达,抑制性细胞如调节性T细胞(Treg)、髓系来源抑制细胞(MDSC)、M2型巨噬细胞以及IL-10、TGF-β等免疫抑制分子在肿瘤微环境中也发挥着独特的免疫抑制作用。此外,复杂的免疫细胞互作网络也使肿瘤微环境成为限制免疫疗法效果发挥的一道坚硬壁垒。
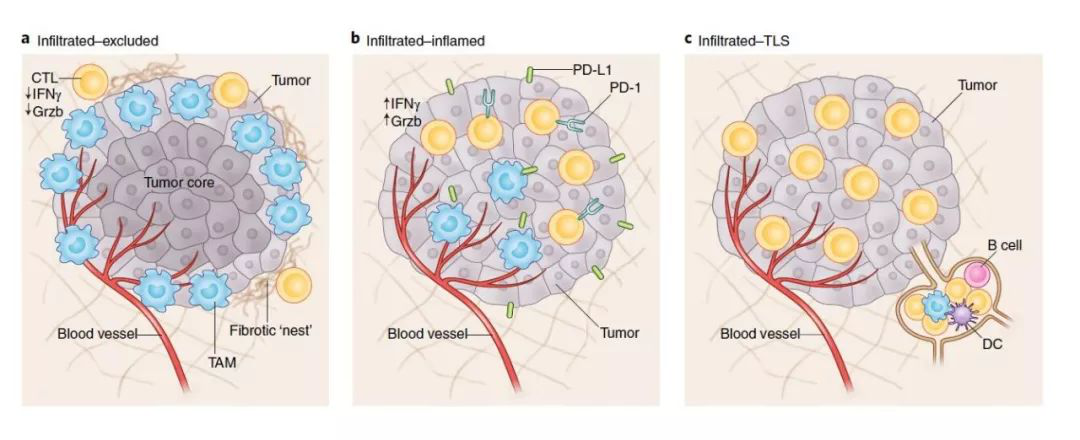
肿瘤微环境TIME的分类,来自nature medicine[10]
正是基于对肿瘤免疫抑制微环境调控的关注以及对于GPCR功能和信号通路研究坚实基础,刘明耀团队利用高通量测序技术对与肿瘤免疫抑制微环境相关的GPCR开展了大规模筛选,进而发现了与肿瘤相关巨噬细胞功能密切相关的受体Lgr4,并对其在肿瘤微环境的重塑和抗肿瘤免疫应答中的重要作用开展了深入的研究。
研究成果
1. 首先在细胞水平证明,Lgr4是维持巨噬细胞促肿瘤状态的“稳定器”;在Lgr4敲除的骨髓来源巨噬细胞中发现,Lgr4的敲除引起巨噬细胞中M2(促肿瘤)相关基因的表达下调;与此同时,M1(促炎型)相关基因表达上调,巨噬细胞表现为典型的促炎表型;
2. 在Lgr4条件敲除的小鼠体内,发现肿瘤生长被抑制;鉴于巨噬细胞功能性极化与肿瘤发生的密切关系,通过在Lgr4条件敲除(巨噬细胞特异性)的小鼠中建立肿瘤模型,发现小鼠中肿瘤的生长被强烈地抑制,且存活时间也显著延长;并且在Lgr4条件敲除小鼠的肿瘤组织中发现存在大量M1型巨噬细胞和活化的CD8+ T细胞浸润。而在B16F10黑色素瘤小鼠模型中也发现了非常一致的现象。这就证实了Lgr4的存在有利于M2型肿瘤相关巨噬细胞功能和表型的维持,并且这种调控作用对于获得性免疫系统中CD8+ T细胞的募集以及肿瘤微环境的维持是至关重要的。
3. Lgr4与巨噬细胞表型调控在肿瘤治疗中的具有很大应用潜力;通过将Lgr4的胞外段蛋白以及Rspondin1(Lgr4配体)抗体注射到荷瘤小鼠体内,发现Lgr4胞外段蛋白和Rspondin1(Lgr4配体)抗体均能显著抑制了鼠LLC肺癌以及B16F10黑色素瘤的生长;并显著提高肿瘤微环境中M1型巨噬细胞的比例以及CD8+ T细胞的浸润和激活水平,证明Lgr4的阻断有效改变了肿瘤微环境的细胞构成,抑制肿瘤的发生发展,具有广泛的抗肿瘤作用。
4. Lgr4阻断剂与PD-1抗体联用,治疗肿瘤效果显著;分别对LLC和B16F10肿瘤模型小鼠进行单药和联药治疗实验。与已报道的临床结果相似,无论是对于LLC肺癌模型还是B16F10黑色素瘤模型,单独使用PD-1抗体的疗效非常有限,而一旦与Lgr4胞外段蛋白联用,则表现出显著的肿瘤抑制效果;进一步的肿瘤内分析也显示Lgr4阻断剂与PD-1抗体联用明显促进了抗肿瘤免疫细胞的浸润,甚至使原先属于“冷”肿瘤的LLC肺癌变为“热”肿瘤,增强了其对免疫检查点抑制剂治疗的敏感性。
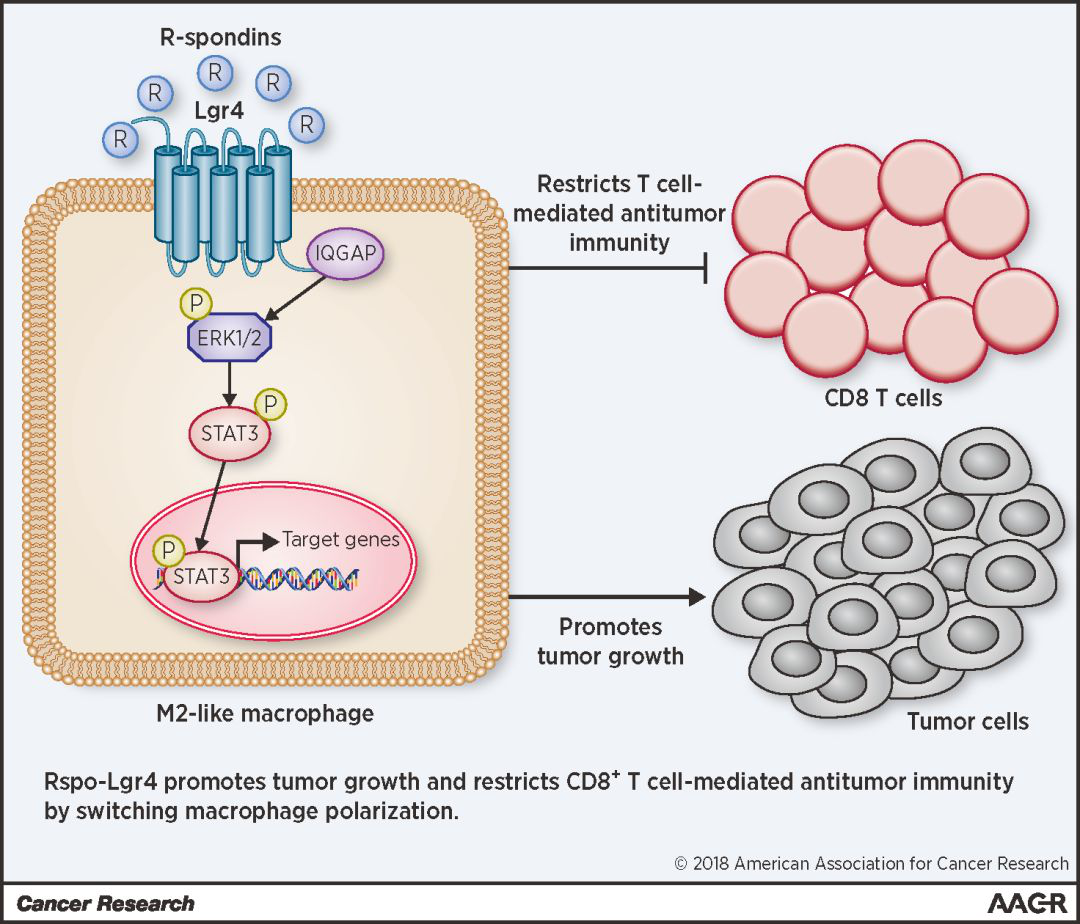
Lgr4通过激活ERK/STAT3信号通路对巨噬细胞M2方向分化的正调控作用[1]
结论:该论文首次揭示G蛋白偶联受体(GPCR)家族成员Lgr4在肿瘤免疫调节中的关键作用,提出并验证了以Lgr4为作用靶点的肿瘤免疫治疗策略。该工作的一大亮点是创造性地将Lgr4阻断剂与PD-1抗体联用,有效地遏制了肿瘤细胞对于单纯免疫检查点封闭疗法的耐受,在小鼠LLC肺癌和B16F10黑色素瘤模型中取得了让人欣喜的治疗效果。
成果转化
综上所述,邦耀科学家刘明耀教授和杜冰教授团队揭示了Lgr4在肿瘤免疫及肿瘤微环境调节中的作用机制,扩展了人们对Lgr4生理功能调控作用的认识,同时为当前炙手可热的肿瘤免疫疗法提供了又一行之有效的作用靶点和治疗策略,具有很大的临床转化潜力。
邦耀生物有幸和华师大的科学家们一起参与肿瘤免疫疗法的研发,目前,上海邦耀生物也已于与华师大共建了“上海基因编辑与细胞治疗研究中心”,正在积极开展肿瘤免疫疗法的基础和转化研究,针对这一重大突破,邦耀和华师大已联合申请多项专利。相信Lgr4在肿瘤免疫微环境中调控功能的发现,会为肿瘤免疫疗法在实体瘤上的应用提供新的思路,未来邦耀公司将结合自己强大的CART细胞治疗和基因编辑技术平台,进一步扩展Lgr4在肿瘤免疫治疗中的应用前景。
参考文献:
1.Tan B, Shi X, Zhang J, Qin J, Zhang N,Ren H, et al. Inhibition of Rspo-Lgr4facilitates checkpoint blockade therapy by switching macrophage polarization.Cancer Research 2018
2.CarmonKS, Gong X, Lin Q, Thomas A, Liu Q. R-spondins function as ligands of theorphan receptors LGR4 and LGR5 to regulate Wnt/beta-catenin signaling. ProcNatl Acad Sci U S A 2011;108:11452-7
3.CarmonKS, Gong X, Yi J, Thomas A, Liu Q. RSPO–LGR4 functions via IQGAP1 to potentiateWnt signaling. Proceedings of the National Academy of Sciences 2014;111:E1221
4.MendiveF, Laurent P, Van Schoore G, Skarnes W, Pochet R, Vassart G. Defectivepostnatal development of the male reproductive tract in LGR4 knockout mice.Developmental biology 2006;290:421-34
5.Planas-PazL, Orsini V, Boulter L, Calabrese D, Pikiolek M, Nigsch F, et al. The RSPO–LGR4/5–ZNRF3/RNF43 module controls liver zonationand size. Nature Cell Biology 2016;18:467
6.GongX, Yi J, Carmon KS, Crumbley CA, Xiong W, Thomas A, et al. Aberrant RSPO3-LGR4 signaling in Keap1-deficient lungadenocarcinomas promotes tumor aggressiveness. Oncogene 2014;34:4692
7.LuoJ, Yang Z, Ma Y, Yue Z, Lin H, Qu G, etal. LGR4 is a receptor for RANKL and negatively regulates osteoclastdifferentiation and bone resorption. Nature medicine 2016;22:539
8.DuB, Luo W, Li R, Tan B, Han H, Lu X, etal. Lgr4/Gpr48 negatively regulates TLR2/4-associated pattern recognitionand innate immunity by targeting CD14 expression. The Journal of biologicalchemistry 2013;288:15131-41
9.Yue Z, Yuan Z, Zeng L, et al. LGR4 modulatesbreast cancer initiation, metastasis, and cancer stem cells. FASEB J. 2018May;32(5)
10.Binnewies M, Roberts EW,Kersten K, et al. Understanding thetumor immune microenvironment (TIME) for effective therapy. Nat Med. 2018May;24(5)